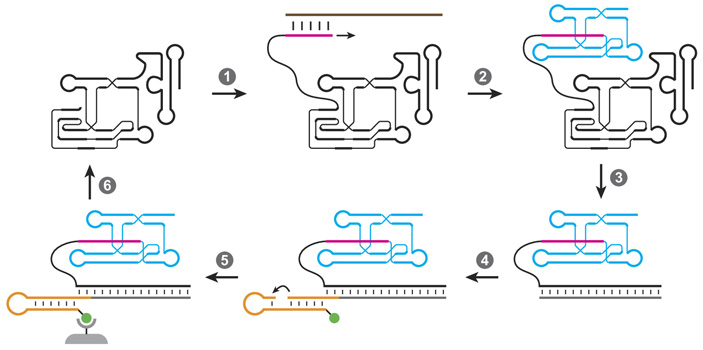

Рис. 1. Искусственный отбор рибозимов-полимераз на способность синтезировать работающий рибозим-лигазу. Такой отбор позволил вывести более совершенную полимеразу, которая размножает молекулы РНК с точностью, достаточной для того, чтобы обеспечить дарвиновскую эволюцию простых рибозимов без помощи белковых ферментов. Пояснения в тексте. Рисунок из обсуждаемой статьи
Одним из важнейших этапов развития РНК-жизни было появление рибозимов-полимераз (молекул РНК, размножающих молекулы РНК), достаточно точных, чтобы полезная наследственная информация не терялась, а накапливалась в ряду поколений. До сих пор экспериментаторам не удавалось получить столь точные рибозимы-полимеразы. Американским ученым удалось это сделать при помощи нового метода искусственной эволюции. Новый рибозим-полимераза размножает простейшие рибозимы с такой точностью, что наследственная информация не деградирует в ряду поколений. Вместо этого происходит накопление полезных мутаций и рост «приспособленности» размножаемых молекул, то есть настоящая дарвиновская эволюция в пробирке без участия белковых ферментов. Это важный шаг к воссозданию РНК-жизни в лабораторных условиях. Следующей задачей является получение рибозимов-полимераз с таким уровнем точности, который позволил бы им обеспечить эволюцию более крупных рибозимов, в том числе самих себя.
Теория РНК-мира за четыре десятилетия своего существования прошла путь от красивой, но чисто умозрительной идеи (W. Gilbert, 1986. Origin of life: The RNA world) до солидной и почти общепризнанной теории, подкрепляемой большим массивом экспериментальных данных (см. ссылки в конце новости). Сейчас параллельно развивается целый ряд направлений экспериментальной работы, фокусирующихся на разных этапах становления и развития РНК-мира: от абиогенного синтеза нуклеотидов, полимеризации случайных молекул РНК на минеральных матрицах и неферментативной репликации до происхождения рибосомы и программируемого синтеза белков.
Одним из таких направлений является изучение рибозимов-полимераз, то есть таких молекул РНК, которые катализируют размножение (репликацию) молекул РНК. На самых ранних этапах становления РНК-мира молекулы РНК, вероятно, реплицировались неферментативно, то есть без участия сложных катализаторов, таких как рибозимы или, тем более, белковые ферменты (см. А. Марков. В поисках начала эволюции). В дальнейшем должны были эволюционировать всё более эффективные, быстрые и точные рибозимы-полимеразы. У современных живых организмов таких рибозимов нет: репликацию нуклеиновых кислот обеспечивают эффективнейшие белковые полимеразы, которые, надо полагать, давно вытеснили своих неуклюжих РНК-предшественников. Но если теория РНК-мира в принципе верна, то в прошлом, до появления рибосомного синтеза белков (и, соответственно, до начала эволюции полноценных белковых ферментов), скорее всего, существовали рибозимы-полимеразы, эффективность которых была достаточной для того, чтобы обеспечить полноценную дарвиновскую эволюцию сложных функциональных молекул РНК. Ну а если такие рибозимы существовали в прошлом, то их можно воссоздать в лаборатории.
Ученые пытаются это сделать начиная с 1990-х годов, комбинируя методы искусственной эволюции и разумного дизайна. Рабочие характеристики выведенных в лаборатории рибозимов-полимераз шаг за шагом улучшаются. Об одном из этапов этого пути рассказано в новости Рибозимы могут размножать друг друга («Элементы», 13.04.2011). С тех пор было сделано еще несколько шагов в сторону совершенствования рибозимов-полимераз (K. Tjhung et al., 2020. An RNA polymerase ribozyme that synthesizes its own ancestor).
Однако до сих пор не удавалось преодолеть принципиально важный рубеж, связанный с точностью репликации (см. Error threshold). Для того, чтобы размножаемые полимеразой молекулы РНК могли эволюционировать по Дарвину, необходим определенный уровень точности копирования, называемый иногда «порогом Эйгена». Если точность ниже этого уровня, отбор не сможет справиться со своими главными задачами: отбраковкой вредных мутаций и закреплением полезных. В результате наследственная информация не будет ни сохраняться, ни накапливаться в ряду поколений, а будет только деградировать и исчезать. Рибозимы будут терять функциональность, превращаясь в случайные нуклеотидные последовательности.
Какой именно уровень точности репликации соответствует порогу Эйгена, зависит от параметров отбора: чем он эффективнее, тем больше ошибок может позволить себе полимераза. При параметрах, считающихся реалистичными (хотя тут все очень спорно и трудно измеряемо в эксперименте), порог Эйгена лежит где-то в диапазоне от одной до нескольких мутаций на геном за поколение. До сих пор ни один рибозим-полимераза (не говоря уж о неферментативной репликации РНК) не добивался такой точности, даже если в роли «генома», подлежащего репликации, выступает совсем маленький и простенький (но все-таки выполняющий какую-то функцию) рибозим.
В статье, опубликованной недавно в журнале PNAS, группа американских исследователей во главе с Джеральдом Джойсом (Gerald Joyce) сообщила о преодолении этого важнейшего рубежа. Джойс давно занимается проблемой происхождения жизни. О других его работах рассказано в новостях Эволюция под управлением компьютера («Элементы», 12.04.2008), Тайна происхождения жизни скоро будет разгадана? («Элементы», 12.01.2009) и Созданы рибозимы, синтезирующие зеркальные копии самих себя («Элементы», 03.11.2014).
В новой статье описан рибозим-полимераза с рекордным уровнем точности. Вывести его удалось при помощи искусственной эволюции. За основу ученые взяли прежнего чемпиона — полимеразу 52-2, недавно выведенную тоже командой Джойса (X. Portillo et al., 2021. Witnessing the structural evolution of an RNA enzyme). Отбор осуществлялся по схеме, показанной на рис. 1. На первом этапе (стрелка 1) к рибозиму-полимеразе (слева вверху) присоединяли праймер (сиреневый) — затравку, с которой должен начаться процесс репликации. Праймер комплементарен кончику матрицы (коричневая) — молекулы РНК, которая кодирует довольно крупный и сложный рибозим-лигазу (рибозимы-лигазы сшивают друг с другом кончики нитей РНК). Полимераза реплицировала матрицу, удлиняя праймер, и в результате получался рибозим-лигаза (голубой), пришитый к праймеру; матрицу после этого удаляли (стрелка 2). Чем точнее полимераза реплицировала матрицу, тем выше шанс, что получившаяся лигаза будет хорошо работать. На следующем этапе (стрелка 3) с помощью белковых ферментов осуществляли обратную транскрипцию полимеразы, то есть синтезировали ДНК-реплику рибозима-полимеразы (серая). К ней потом (стрелка 4) пришивали конструкцию из двух молекул РНК (оранжевые), к одной из которых прикреплена молекула биотина (зеленая). Это распространенный прием, позволяющий отбирать молекулы РНК или ДНК с нужными свойствами, потому что биотин накрепко прилипает к магнитным шарикам, покрытым стрептавидином (подробнее об этой технологии см. в новости Искусственные полимеры могут хранить генетическую информацию, «Элементы», 23.04.2012). Если полимераза сработала удачно и синтезировала хорошую лигазу, то эта лигаза сшивала вместе две части оранжевой конструкции (стрелка 5). В результате удачливая полимераза (точнее, ее ДНК-реплика) оказывалась пришита к биотинилированному кончику оранжевой РНК-конструкции. Это позволяло ее поймать и отделить от неточных полимераз, синтезировавших мутантные неработающие лигазы и поэтому не пришившиеся к биотину. Отобранные таким способом успешные полимеразы размножались при помощи ПЦР с внесением небольшого числа случайных мутаций и запускались в следующий цикл искусственной эволюции (стрелка 6).
Ученые провели 18 раундов такого отбора. При этом они постепенно уменьшали время, отведенное полимеразе для репликации матрицы (начали с 20 часов, закончили одним часом), и снижали концентрацию ионов Mg2+. Присутствие этих ионов необходимо как для неферментативной репликации РНК, так и для репликации, катализируемой рибозимами-полимеразами. При высокой концентрации ионов магния скорость репликации РНК, как правило, повышается, но точность снижается. Поэтому для выведения точной полимеразы важно было приучить ее работать при низкой концентрации Mg2+.
В итоге была выведена полимераза, получившая название 71-89. Она состоит из 182 нуклеотидов и отличается от своего предка, полимеразы 52-2, десятью мутациями (рис. 2). Стоит пояснить, что полимеразу 52-2 выводили похожим способом, однако требования к точности копирования в ходе отбора были менее строгими. Чтобы не быть отбракованной, полимераза должна была синтезировать рабочую копию очень простого рибозима с минимальным числом консервативных (функционально важных) нуклеотидных позиций. Чем меньше синтезируемый рибозим и чем меньше в нем консервативных позиций, тем менее точной должна быть полимераза, чтобы произвести заданный процент небракованной продукции. В результате отбор шел в основном на способность реплицировать матрицу хоть как-то. Поэтому полимераза 52-2 получилась менее точной, чем ее нововыведенный потомок — полимераза 71-89, предкам которой приходилось синтезировать большую и сложную лигазу.
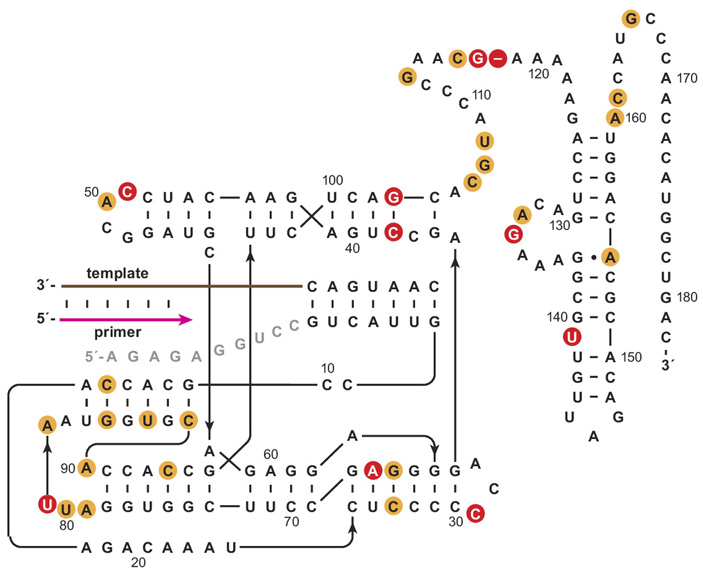
Рис. 2. Новый рибозим-полимераза 71-89. Красными кружками обозначены 10 мутаций, отличающих его от исходной версии 52-2; оранжевыми — мутации, закрепившиеся раньше, когда выводили 52-2. Рисунок из обсуждаемой статьи
В дальнейших экспериментах авторы показали, что старая полимераза 52-2 не дотягивает до порога Эйгена и не может обеспечить дарвиновскую эволюцию простейшего рибозима hammerhead (HHR), а новая полимераза 71-89 справляется с этой задачей.
Чтобы это выяснить, между двумя рибозимами-полимеразами устроили настоящее эволюционное соревнование. Одной из проблем, успешно решенных в ходе организации этого соревнования, был поиск такого варианта рибозима HHR, который старая полимераза 52-2 в принципе может реплицировать. Дело в том, что полный цикл репликации HHR (как и любой другой молекулы РНК) состоит из двух этапов. Сначала на матрице рибозима (HHR+) нужно синтезировать его реплику (HHR−), и уже потом на матрице HHR− построить копию исходной последовательности HHR+. Ну а те несовершенные рибозимы-полимеразы, с которыми работают исследователи, очень чувствительны к последовательности нуклеотидов в реплицируемой матрице. Одни последовательности они реплицируют легко, другие с трудом (особенно если матрица норовит свернуться в двойную спираль, образовав так называемую «шпильку»), с третьими вовсе не справляются. Старая полимераза в этом плане капризнее новой. Поэтому стандартный рибозим HHR пришлось модифицировать, чтобы обе полимеразы могли синтезировать и сам рибозим (HHR+), и его реплику (HHR−). Использованный в работе вариант HHR показан на рис. 3. В его структуре есть одна шпилька, обозначенная римской цифрой II.
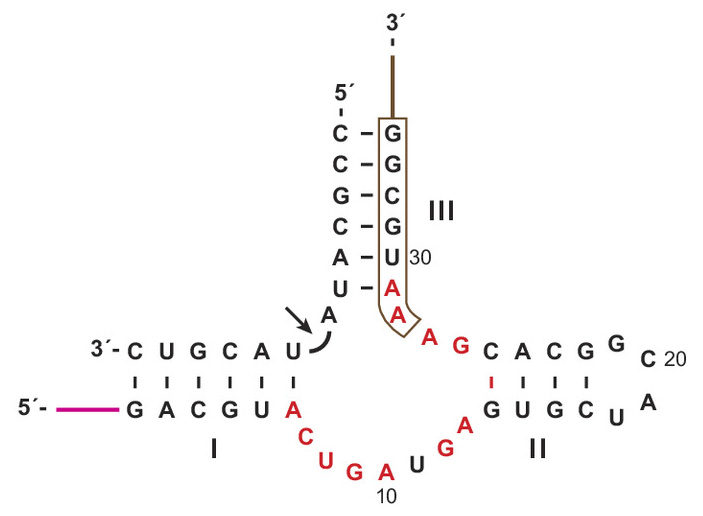
Рис. 3. Версия рибозима Hammerhead (HHR), использованная для проверки способности полимераз 52-2 и 71-89 обеспечивать дарвиновскую эволюцию простейших рибозимов. HHR показан в соединении со своим субстратом — короткой молекулой РНК, которую HHR разрезает в отмеченном стрелкой месте. В этом состоит «функция» HHR. Длина HHR — 34 нуклеотида, однако рибозимам-полимеразам нужно было размножать только 27 из них. Остальные 7 нуклеотидов (обведены рамочкой) они получали «в подарок» в качестве праймера — затравки, с которой начинается репликация. Это одна из нескольких маленьких уловок, из-за которых продемонстрированную в работе «эволюцию рибозимов, размножаемых рибозимами» все-таки нельзя считать абсолютно честной реконструкцией событий, которые могли происходить в РНК-мире. Красным выделены консервативные нуклеотиды, абсолютно необходимые для сохранения функции HHR. Рисунок из обсуждаемой статьи
Эволюционный эксперимент проводился по отдельности с каждой из двух полимераз. Он состоял из восьми раундов искусственной эволюции. Схема одного раунда показана на рис. 4. Сначала полимераза синтезировала HHR− на матрице HHR+ (стрелка 1 на рис. 4), потом она же синтезировала HHR+ на матрице HHR− (стрелка 3), а потом проводился отбор тех HHR+, которые успешно выполнили свою функцию, то есть сумели разрезать молекулу РНК, показанную оранжевым цветом.
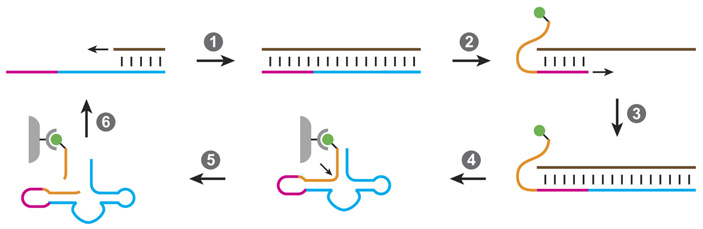

Рис. 4. Схема одного раунда эволюционного эксперимента, в котором рибозим Hammerhead (HHR+, показан голубым цветом) реплицировался рибозимами-полимеразами (не показаны) и подвергался отбору на способность выполнять свою функцию, то есть разрезать «субстрат» — молекулу РНК с определенной последовательностью нуклеотидов (оранжевая, место разреза отмечено маленькой стрелкой). Сиреневым цветом показан семинуклеотидный участок HHR+, который использовался в качестве праймера и который полимеразам не нужно было реплицировать. Зеленый кружок — биотин, который был нужен для закрепления на магнитных шариках неудачных вариантов HHR+, не сумевших разрезать оранжевую последовательность. Варианты, справившиеся с этой задачей, отправлялись в следующий раунд искусственной эволюции. Для каждого из двух тестируемых рибозимов-полимераз было проведено восемь таких раундов. Рисунок из обсуждаемой статьи
После каждого из восьми раундов получившиеся HHR размножались при помощи ПЦР и подвергались всестороннему изучению. Это позволило в деталях проследить их эволюцию. Как выяснилось, она шла совершенно по-разному в зависимости от того, какая полимераза размножала рибозимы HHR — старая 52-2 или новая 71-89.
Старая полимераза 52-2 размножала HHR со средней точностью 81,4%. Это значит, что в одном полном цикле репликации (HHR+ → HHR− → HHR+) правильно воспроизводились 81,4% нуклеотидов, а остальные 18,6% реплицировались неправильно («мутировали»). Поскольку длина реплицируемой части HHR составляет 27 нуклеотидов, средний уровень мутагенеза в расчете на геном за поколение (U) составил 0,186·27 = 5,02. При таком мутагенезе лишь 0,66% потомков не получают ни одной новой мутации (это вычисляется по формуле 1/еU).
Такой точности оказалось недостаточно для полноценной эволюции. Наследственная информация стала быстро деградировать. От раунда к раунду рибозимы HHR неуклонно теряли функциональность. К восьмому раунду они практически полностью утратили способность выполнять свою работу. Если бы отбор функциональных HHR в ходе эксперимента осуществлялся идеально точно, популяция рибозимов, размножаемых полимеразой 52-2, просто вымерла бы. Но процедура отбора не была идеальной, и поэтому небольшое количество нефункциональных HHR все-таки попадало в следующее поколение. Это позволило пронаблюдать процесс мутационной деградации до самого конца.
Секвенирование показало, что последовательности быстро и беспорядочно накапливали случайные мутации. К концу эксперимента большинство из них отличалось от исходного варианта (показанного на рис. 3) по 10–15 нуклеотидным позициям из 27. То, что мутации накапливались хаотично, видно по тому, что в разнообразии последовательностей нет никакой структуры. Если бы отбор мог зацепиться за какие-то удачные варианты и поддержать их, то на тех или иных этапах эксперимента определенные последовательности или группы похожих последовательностей наращивали бы свою численность. Такие доминирующие кластеры последовательностей должны были бы периодически появляться, конкурировать и сменять друг друга. Но ничего подобного не происходило. Вместо этого последовательности диффузно расползались по пространству возможных вариантов. Ни одна из них не достигала высокой численности, и в итоге почти все последовательности оказались далеко за пределами области, соответствующей функциональным рибозимам Hammerhead.
Таким образом, полноценной дарвиновской эволюции не получилось. Имела место прогрессирующая потеря наследственной информации. Функциональные рибозимы в итоге превратились в случайные последовательности нуклеотидов. Порог Эйгена не был преодолен.
Новая полимераза 71-89 открыла перед рибозимами HHR намного более интересные эволюционные возможности. Она размножала их со средней точностью 89,1%, что соответствует уровню U = 2,94 мутаций на геном за поколение. При таком мутагенезе 5,27% потомков не получают ни одной новой мутации — в 8 раз больше, чем у старой полимеразы.
Эволюция рибозимов HHR, размножаемых новой полимеразой, выглядела совершенно по-другому. Перед исследователями предстала картина нормальной дарвиновской адаптивной эволюции. Последовательности менялись не хаотично, как в первом случае, а направленно. Периодически возникали удачные варианты, достигавшие высокой численности, которые затем вытеснялись новыми, еще более удачными вариантами. Поскольку темп мутагенеза был все-таки очень высоким, вокруг каждого удачного варианта сразу возникало «облако» близкородственных последовательностей, отличавшихся друг от друга одной-двумя мутациями. Конкуренция шла именно между такими кластерами. Авторы называют их «квазивидами», используя термин из вирусологии, потому что они действительно похожи на квазивиды, характерные для эволюции вирусов (см. Viral quasispecies).
Подавляющее большинство последовательностей на всем протяжении эксперимента не покидало пределов области, соответствующей функциональным рибозимам Hammerhead. К концу эксперимента в популяции доминировали пять квазивидов, большинство представителей которых отличались от исходной последовательности тремя — пятью мутациями.
Функциональность рибозимов немного снизилась по сравнению с исходным уровнем, но всё равно она оставалась высокой и не проявляла тенденции к дальнейшему снижению. Как показало секвенирование и дополнительные эксперименты, снижение функциональности рибозимов произошло не из-за мутационной деградации, а из-за эволюционного компромисса (см. Evolutionary tradeoff) между двумя разнонаправленными векторами отбора. Дело в том, что в ходе эксперимента отбор шел не только на функциональность рибозима HHR (его способность разрезать субстрат), но и на скорость репликации последовательностей рибозимом-полимеразой 71-89.
Как уже говорилось, рибозимы-полимеразы не безразличны к последовательности нуклеотидов в реплицируемой матрице. Какие-то последовательности они реплицируют легко и быстро, какие-то — с трудом, а с какими-то вовсе не справляются. Большие трудности у рибозимов-полимераз возникают, когда матрица образует двуспиральные участки — «шпильки». У рибозима HHR как раз есть такая шпилька, обозначенная на рис. 3 римской цифрой II. Шпилька необходима рибозиму для выполнения его функции, поэтому отбор на функциональность способствует усилению (повышению стабильности) шпильки. Но она также затрудняет репликацию, поэтому отбор на реплицируемость должен, наоборот, вести к ее ослаблению (дестабилизации).
Оказалось, что в ходе эволюционного эксперимента отбор поддерживал последовательности с определенными мутациями именно в этом участке рибозима HHR. Побеждали те варианты, у которых стабильность шпильки была чуть снижена по сравнению с исходным HHR: достаточно, чтобы повысить эффективность репликации, но не настолько сильно, чтобы нанести серьезный ущерб функциональности рибозима. Эволюция сумела найти несколько удачных вариантов, при которых снижение функциональности с лихвой окупается ростом реплицируемости.
Итоговая «приспособленность» рибозимов в условиях эксперимента складывалась их трех компонентов: функциональности рибозима, эффективности синтеза HHR+ и эффективности синтеза HHR−. Авторы измерили приспособленность вариантов-победителей тремя разными методами, в том числе при помощи прямого эволюционного состязания между вариантами. Оказалось, что к концу эксперимента в популяции преобладали варианты, приспособленность которых была существенно выше, чем у исходного HHR. Таким образом, налицо все признаки полноценной дарвиновской эволюции, включая рост приспособленности.
Исследование представляет собой важный шаг на пути к воссозданию РНК-жизни в пробирке. Конечно, предстоит еще много работы, прежде чем эта грандиозная цель будет достигнута. Рибозимам-полимеразам пока еще требуется много помощи со стороны. Эту помощь исследователи предоставляют в том числе с использованием белковых ферментов. Например, на некоторых этапах циклов, показанных на рис. 1 и 3, используется обратная транскрипция и ПЦР. К тому же рибозимы получают в дар от исследователей праймеры — затравки, необходимые для начала репликации.
Кроме того, точность репликации все еще недостаточна для того, чтобы обеспечить адаптивную эволюцию самих рибозимов-полимераз. Длина полимеразы 71-89 составляет 182 нуклеотида. Чтобы преодолеть порог Эйгена в условиях, близких к тем, что использовались в обсуждаемой работе, частота мутирования U, вероятно, не должна превышать трех мутаций на геном за поколение (при размножении HHR полимеразой 71-89 величина U составляет 2,94). Если речь идет о размножении 182-нуклеотидного рибозима (это длина полимеразы 71-89), то для U = 3 нужна точность репликации 98,4%. Это намного больше, чем у полимеразы 71-89 (89,1%). Но авторы полны оптимизма. Ведь им удалось за 18 раундов отбора повысить точность полимеразы от 81,4% до 89,1%. Тем самым они опровергли высказывавшееся предположение, что искусственные рибозимы-полимеразы уже достигли предела совершенства, и дальше улучшать их не получится.
Кроме того, есть интересные обходные варианты. В обсуждаемой статье речь идет о полимеразах, осуществляющих репликацию путем последовательного присоединения одиночных нуклеотидов. Однако известно, что эффективность репликации можно существенно повысить, если в качестве строительных блоков использовать не отдельные нуклеотиды, а коротенькие последовательности — олигонуклеотиды (например, триплеты) или смесь одиночных нуклеотидов с олигонуклеотидами. Помимо прочего, такой подход открывает пути к решению проблемы праймеров, равно как и проблемы репликации сильно структурированных (скрученных в двойные спирали) последовательностей (см., например: J. Attwater et al., 2018. Ribozyme-catalysed RNA synthesis using triplet building blocks). В общем, нынешнее положение дел в науке об РНК-мире не похоже на застревание в тупике и топтание на месте. Наблюдается уверенный прогресс на многих фронтах, так что есть основания надеяться на новые интересные открытия.
Источник: Nikolaos Papastavrou, David P. Horning, Gerald F. Joyce. RNA-catalyzed evolution of catalytic RNA // PNAS. 2024. DOI: 10.1073/pnas.2321592121.
См. также:
1) Рибозимы могут размножать друг друга, «Элементы», 13.04.2011.
2) Созданы рибозимы, синтезирующие зеркальные копии самих себя, «Элементы», 03.11.2014.
3) Тайна происхождения жизни скоро будет разгадана?, «Элементы», 12.01.2009.
4) Угрожают ли химеры гипотезе «мира РНК»?, «Элементы», 19.05.2021.
5) Синтез РНК в «протоклетках» всё-таки возможен, «Элементы», 02.12.2013.
6) А. Марков. В поисках начала эволюции // Природа. 2015. №1.
7) Происхождение жизни: неферментативная репликация // Троицкий вариант №26, 2023.
8) Михаил Никитин. Происхождение жизни. От туманности до клетки.
Александр Марков
